¿Qué es?
Con
frecuencia la corrosión se confunde con un simple proceso de oxidación siendo
en realidad un proceso más complejo, el cual puede puntualizarse como la
gradual destrucción y desintegración de los materiales debido a un proceso
electroquímico, químico o de erosión debido a la interacción del material con
el medio que lo rodea.
Factores
La
velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, la
salinidad del medio y las propiedades de los materiales en cuestión, entre
ellos pueden mencionarse los procesos de desgaste por fricción, por erosión o
por diversos factores mecánicos.
Una
característica importante de los procesos de corrosión es que los eventos
ocurren espontáneamente en la naturaleza.
La
corrosión ordinaria, es un proceso redox por el cual los metales se oxidan por
medio del oxígeno O2, en presencia de humedad. El oxígeno en estado
gaseoso es un agente oxidante, y la mayoría de los metales tienen potenciales
de reducción menores que éste, por lo tanto son fácilmente oxidables.
¿Cómo ocurre?
Se
sabe que la oxidación de los metales tiene lugar más fácilmente en puntos
donde la tensión es mayor (donde los metales son más “activos”). Así, un clavo
de acero, que en su mayor parte es hierro, se corroe primero en la punta y en
la cabeza. Un clavo doblado se corroe más fácilmente en el recodo.
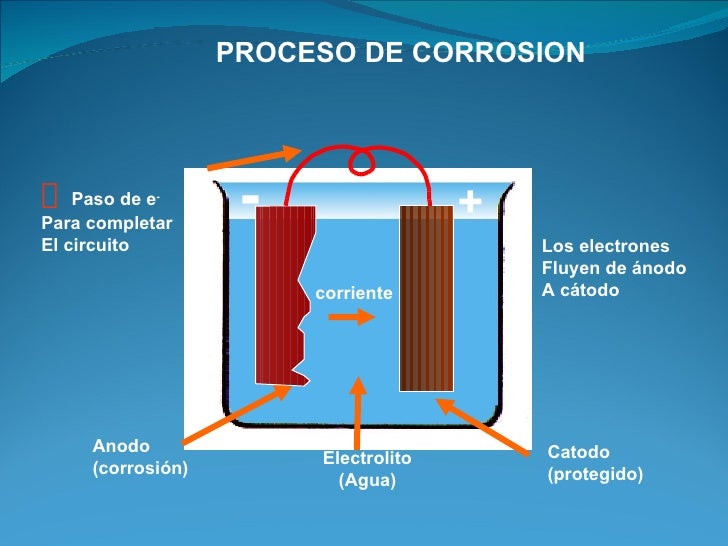
La
celda que causa este proceso está compuesta esencialmente por tres componentes:
un ánodo, un cátodo y un electrolito (la solución conductora de electricidad).
El ánodo es el lugar donde el metal es corroído: el electrolito es el medio
corrosivo; y el cátodo, que puede ser parte de la misma superficie metálica o
de otra superficie metálica que esté en contacto, forma el otro electrodo en la
celda y no es consumido por el proceso de corrosión. En el ánodo el metal
corroído pasa a través del electrolito como iones cargados positivamente,
liberando electrones que participan en la reacción catódica. Es por ello que la
corriente de corrosión entre el ánodo y el cátodo consiste en electrones
fluyendo dentro del metal y de iones fluyendo dentro del electrolito.
 Aunque
el aire atmosférico es el medio más común, las soluciones acuosas son los
ambientes que con mayor frecuencia se asocian a los problemas de corrosión. En
el término solución acuosa se incluyen aguas naturales, suelos, humedad
atmosférica, lluvia y soluciones creadas por el hombre. Debido a la
conductividad iónica de estos medios, el ataque corrosivo es generalmente
electroquímico.
Aunque
el aire atmosférico es el medio más común, las soluciones acuosas son los
ambientes que con mayor frecuencia se asocian a los problemas de corrosión. En
el término solución acuosa se incluyen aguas naturales, suelos, humedad
atmosférica, lluvia y soluciones creadas por el hombre. Debido a la
conductividad iónica de estos medios, el ataque corrosivo es generalmente
electroquímico.
En
los procesos de corrosión electroquímica de los metales se tiene
simultáneamente un paso de electrones libres entre los espacios anódicos y
catódicos vecinos, separados entre sí, según el esquema siguiente:
Fenómeno anódico: Ed1 Ec1 +
n e-
Ec1 +
n e-
Fenómeno catódico: Ec2 + n e- Ed2
Ed2
Lo
que entraña una corriente electrónica a través de la superficie límite de las
fases. En el proceso anódico, el dador de electrones, Ed1, los cede
a un potencial galvánico más negativo, y dichos electrones son captados en el
proceso catódico por un aceptor de electrones, Ec2, con potencial
más positivo.
Como
vemos la corrosión electroquímica involucra dos reacciones de media celda, una
reacción de oxidación en el ánodo y una reacción de reducción en el cátodo. Por
ejemplo para la corrosión del hierro en el agua con un pH cercano a
neutralidad, estas semirreacciones pueden representarse de la siguiente manera:
Reacción catódica : O2 + 2H2O + 4e-
Por
supuesto que existen diferentes reacciones anódicas y catódicas para los
diferentes tipos de aleaciones expuestas en distintos medios.
Tipos de corrosión
Se clasifican de acuerdo a la
apariencia del metal corroído, dentro de las más comunes están:
- Corrosión uniforme: Donde la corrosión química o electroquímica actúa uniformemente sobre toda la superficie del metal
- Corrosión galvánica: Ocurre cuando metales diferentes se encuentran en contacto, ambos metales poseen potenciales eléctricos diferentes lo cual favorece la aparición de un metal como ánodo y otro como cátodo, a mayor diferencia de potencial el material con más activo será el ánodo.
- Corrosión por picaduras: Aquí se producen hoyos o agujeros por agentes químicos.
- Corrosión intergranular: Es la que se encuentra localizada en los límites de grano, esto origina pérdidas en la resistencia que desintegran los bordes de los granos.
- Corrosión por esfuerzo: Se refiere a las tensiones internas luego de una deformación en frio.
Protección
contra la corrosión
Dentro de las medidas utilizadas
industrialmente para combatir la corrosión están las siguientes:
- Uso de materiales de gran pureza.
- Presencia de elementos de adición en aleaciones, ejemplo aceros inoxidables.
- Tratamientos térmicos especiales para homogeneizar soluciones sólidas, como el alivio de tensiones.
- Inhibidores que se adicionan a soluciones corrosivas para disminuir sus efectos, ejemplo los anticongelantes usados en radiadores de los automóviles.
- Recubrimiento superficial: pinturas, capas de óxido, recubrimientos metálicos
- Protección catódica.
Problemática
Como
se dijo anteriormente, la corrosion se presenta en metales. Por lo mismo, una de las mayores problemáticas es que la
corrosión afecte principalmente a esta clase de elementos. Ello implica
muchos tipos de problemas, de los cuales la mayoría son bastante serios,
a los que nos referiremos más adelante, ya que primero conviene conocer
las diversas clases de corrosión existentes.
Aún
así, mencionemos que este proceso en sus variadas formas (dentro de las
cuales se puede presentar) va produciendo un deterioro considerable en
las clases de metales que afecta, los cuales con el tiempo, si no son
tratados, inducen a su completa destrucción, lo cual implica también
enormes pérdidas económicas y de producción.
Conclusiones
Si bien es cierto que la corrosión es un fenómeno natural y sucede espontáneamente, no tenemos que vivir con ella, y mucho menos pasarla por alto mediante pequeños retoques de pintura para mitigar los indicios de dicho problema. El fenómeno de la corrosión ocurre constantemente.
Los efectos de la corrosión en nuestra
vida diaria se observan en los objetos que se encuentran alrededor, como en carros, el enrejado
de las ventanas, o en las herramientas metálicas.
Una de las consecuencias más serias
de la corrosión sucede cuando afecta nuestras vidas
en el desarrollo cotidiano. Cuando nos dirigimos de la casa
al trabajo o la escuela, se puede observar una serie de problemas
debido al fenómeno de la corrosión. A su vez, podrían dañar construcciones, edificios,
parques y otros, y además implicarían una reparación
costosa y el bienestar de las personas.
Es posible que entre todos los problemas que causa la corrosión uno de los más peligrosos sea el que ocurre en las industrias, ya que dañan la infraestructura y provoca que las actividades no se desarrollen en optimas condiciones.
Por las razones anteriormente mencionadas, es necesario tomar medidas preventivas y conocer acerca del tema para saber como tratar con la corrosion sin que afecte lo que nos rodea.